世和基因HRD检测获PCT国际发明专利授权
近日,世和基因“同源重组缺失的标志物、检测方法以及检测系统”专利技术成功获得加拿大知识产权局授权(CAN3147427),这是公司取得的第3项PCT国际发明专利。至此,世和基因已拥有自主发明专利近60项。
PCT(Patent Cooperation Treaty)是专利领域中一个极为重要的国际合作条约。通过PCT,申请人可以同时在包括加拿大、美国、欧盟国家在内的全球一百多个成员国对其发明专利进行保护。我国于1994年正式成为PCT成员国。
世和HRD检测性能优异
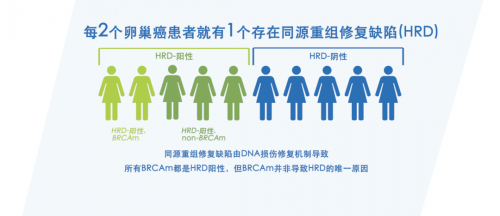
同源重组缺陷(homologous recombination deficiency,HRD)通常由HRR相关基因胚系突变或体细胞突变以及表观遗传失活等诸多因素导致,常存在于多种恶性肿瘤中,其中在卵巢癌、乳腺癌、胰腺导管癌、前列腺癌等肿瘤中尤其突出。HRD会产生特定的、可量化的、稳定的基因组改变,可通过建立基于基因组特征分析的评估体系来预测肿瘤HRD状态及其程度,已成为晚期卵巢癌患者临床应用PARP抑制剂的新型生物标志物,也可能对乳腺癌、前列腺癌等肿瘤的PARP抑制剂和铂类药物的临床用药具有指导价值[1]。
2020年,FDA批准了奥拉帕利与贝伐珠单抗联用作为HRD阳性卵巢癌患者一线维持治疗方案。HRD检测,可将PARP抑制剂获益人群从原先的20%(BRCA1/2阳性)提升至50%(HRD阳性),使得更多患者从中获益[2]。
值得欣喜的是,近日新版国家医保目录公布,“奥拉帕利联合贝伐珠单抗用于同源重组修复缺陷(HRD)阳性的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗联合贝伐珠单抗治疗达到完全缓解或部分缓解后的维持治疗 ”适应症被新增纳入医保。这意味着,HRD检测阳性患者用药可医保全面覆盖。HRD检测作为患者管理的重要组成部分,其重要性日益突出。
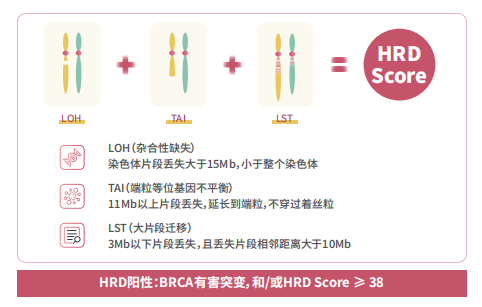
世和基因基于该项专利技术自主研发的盼汝胜®GeneseeqPrime® HRD产品早在2020年就已上线,并于2023年获欧盟CE认证。该产品依托中国人群大数据平台开发,针对中国人SNPs位点进行探针设计,均匀覆盖全基因组,通过综合评估LOH、TAI和LST判断基因组瘢痕评分。基于该技术,世和基因与复旦大学附属肿瘤医院吴小华教授团队合作开展HRD验证研究,证实HRD状态在中国卵巢癌患者铂类敏感性的预测价值,文章已发表于BMC Cancer[3]。
持续创新助力全球化布局提速
近年来,世和基因在科研投入、创新平台建设等方面持续加大力度,在中国南京和加拿大多伦多设立了由国内外硕博组成的全资研发中心,并通过加强与国内外高校、研究机构、专家团队的产学研合作,积极推动科研成果临床转化,多项自主发明专利技术为国内首创。
自2017年起,世和基因凭借全球化战略,已将业务服务和销售网络延伸至北美、中东、欧洲和东南亚等多个地区。公司在PCT国际专利申请中取得的优异成绩,有力推动了中国原创的肿瘤NGS检测技术迈向国际市场。此次,世和HRD(同源重组缺陷)检测技术成功获得国际专利,不仅是公司全球化业务拓展战略的又一重要成果,也将进一步增强世和在国际市场的竞争力。让中国技术,服务全球。
参考文献
[1]同源重组修复缺陷临床检测与应用专家共识(2021版)
[2]中国抗癌协会妇科肿瘤专业委员会, & 中华医学会病理学分会. (2020). 上皮性卵巢癌parp抑制剂相关生物标志物检测的中国专家共识. 中国癌症杂志, 30(10), 841-848.
[3]Wen H, Feng Z, Ma Y T, et al. Homologous recombination deficiency in diverse cancer types and its correlation with platinum chemotherapy efficiency in ovarian cancer[J]. BMC Cancer, 2022.
